来源: 望望同学丫丫爸爸 小丫丫自闭症 2024-03-11 19:38 美国前言
正如前文提到的,基因治疗研究,目前真正有进展的是几个所谓的单基因机制的自闭症和相关障碍,包括:天使综合征(UBE3A),雷特综合征(MECP2),脆性染色体X综合征(FMR1),Phelan-McDermid (SHANK3),SCN2A,CHD8等。
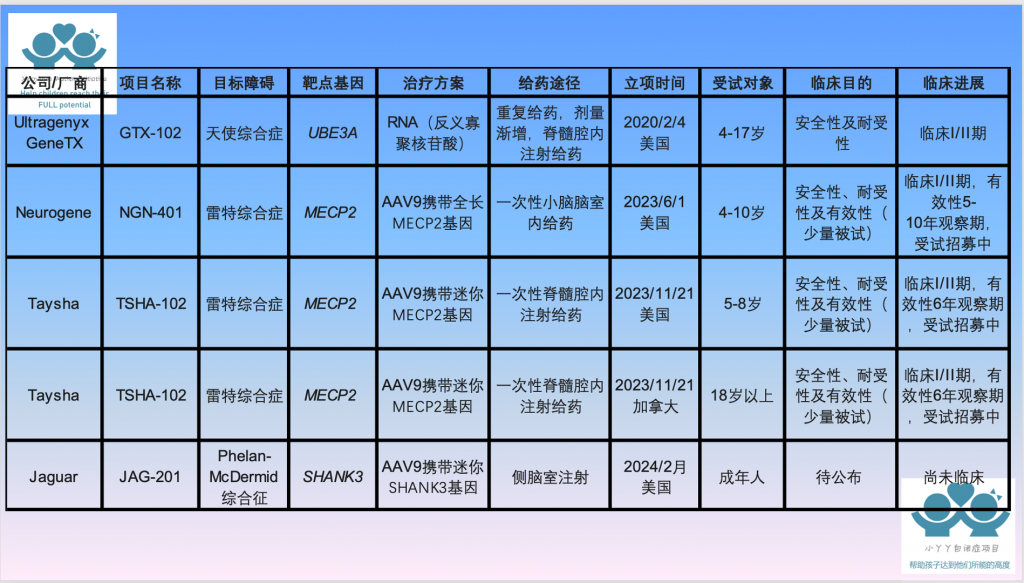
根据Clinicaltrials的注册信息以及相关厂商官方信息,我们将现有五项自闭症(类)临床试验的进行总结。如果自闭症个体进行了基因测序,正好有相同的基因变异,可以去咨询相关公司的进展情况。
一波三折的“天使综合征”基因治疗方案——GTX-102
摘要:
天使综合症(Angelman Syndrome)的GTX-102项目,是最早立项、通过FDA审批,并投入临床试验的基因治疗方案。然而,因为曾经出现给药后严重的不良反应,被FDA叫停两年时间。Ultragenyx GeneTX修改了原先的方案,降低副作用,FDA再次对其放行,公司又完成了一次临床试验,目前还在数据整理总结中。
天使综合症遗传致病原理。图片来源:(国际)天使综合症基金会, https://www.angelman.org/what-is-as/genetics-of-angelman-syndrome/)
天使综合征的基因机制:
天使综合症因为儿童常常表现出一种高兴的状态,他们微笑或大笑,异常兴奋,以及宛如天使般的面容,因而被命名为“天使综合症”。天使综合征是一种罕见的基因疾病,发病率1:15,000,常见的表现有发育迟缓,婴幼儿常常不能达到常见临床发育的里程碑。同时,一般伴有智力障碍、癫痫、运动及语言障碍、睡眠障碍,以及部分自闭症特质。该病无法治愈,但症状可随年龄增长而减轻。(来源:(国际)天使综合症基金会,https://www.angelman.org/what-is-as/symptoms-and-causes/)
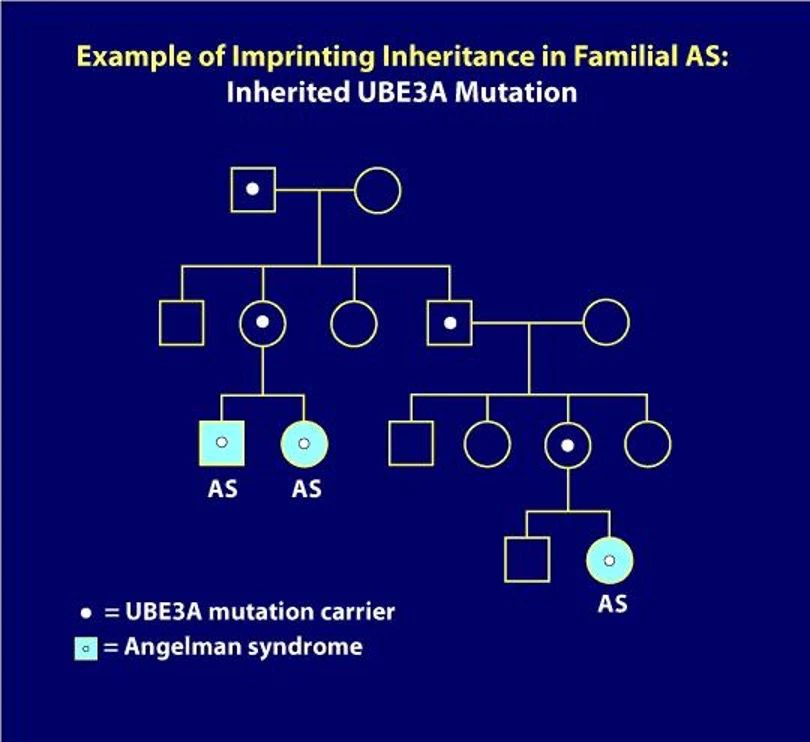
天使综合征的基因机制被认为是个体体内来自母亲的UBE3A基因发生突变或者缺失,导致该蛋白无法正常表达而致病。UBE3A基因编码蛋白是泛素蛋白(ubiquitin)的一种。泛素是一种存在于大多数真核细胞中的小分子蛋白,主要功能是标记那些待降解的蛋白质,从而被蛋白酶发现而水解——简单说,泛素蛋白就像体内的垃圾分解系统,找到多余的蛋白,然后清除。目前已知UBE3A广泛参与神经系统的发育,以及出生后的神经突触修剪等多种生理活动。
在人体细胞内,来自父亲的UBE3A由于来自母亲的UBE3A的存在而被天然沉默抑制,生理功能主要由来自母亲的UBE3A基因实现。而天使综合症人群,母系的UBE3A基因发生突变或者缺失,导致突变的蛋白无法表达,或者执行正确的生理功能。
天使综合征的基因治疗方案:
天使综合征的GTX-102基因治疗方案就是试图抑制携带突变的母系UBE3A基因,从而使原本沉默的父系UBE3A基因启动表达,实现该蛋白的功能。
GTX-102是一种短RNA类的经化学修饰的反义寡聚核苷酸(antisense oligonucleotide,ASO),注入体内后,试图抑制有突变的母系UBE3A,从而激活父系UBE3A的基因表达,恢复生理功能。GTX-102不依赖任何病毒载体送达人体,不会出现机体对于病毒的免疫反应。GTX-102是通过腰椎穿刺,进行脊髓腔内注射给药,直接送达到中枢神经系统。同时,GTX-102需要重复多次注射,保证体内有足够多的ASO,因此给药方式上伴随着一些操作风险。
但是,GTX-102能否真正激活体内的来自父亲的UBE3A基因,以及激活之后的蛋白表达能否达到足够的水平,从而真正起作用,还需要进一步证实。ASO多次重复的腰椎穿刺,脊髓腔内注射给药的方式,还必须根据病情适当更改剂量,在临床操作上有一定的风险。而更令人担心的两点:药物能否准确地输送进特定的脑区和特定的细胞类型;短链核苷酸ASO尽管已经进行了大量的目标基因比对,但是,在面对人体基因组的汪洋大海时,会不会有脱靶效应或者其他的一些未考虑到的影响。
临床试验的一波三折:
2020年GTX-102进入临床I/II期试验,首期招募5名天使综合症儿童进行安全性及耐受性测试,一开始进展良好。然而,随着药物剂量的增加,在给药128天后,所有5名被试都出现了腿部无力等不良反应,有一个孩子甚至丧失了行走能力。FDA因此在2020年11月被FDA紧急叫停了GTX-102的临床试验。
Ultragenyx GeneTX分析认为该副作用是由于过多药物在注射的腰椎区域累积有关,因而对药物剂量、给药时间等做了一些调整后,FDA同意继续进行GTX-102的临床试验。2021年10月,该公司重新招募了14名被试,按照新的给药剂量和给药方式继续试验。目前试验进行了将近一年(337天),大部分受试者的症状得到改善,其中半数( 7名)受试者没有出现此前腿部无力的不良反应,另外一半数(7名)受试者随着药物剂量的增加,依旧出现了腿部无力等不良反应。(来源:FDA官网参考资料1)
据SpectrumNews的新闻采访报道,Ultragenyx GeneTX对于该药的临床总体结果表示满意,但是还在继续改进给药剂量和给药方式,以消除不良反应。
目前,Ultragenyx GeneTX正在进行前期临床数据总结,以及筹划新一期更大规模、更多中心的伴随随机组临床试验,预期在2025年底结束本期临床试验。(来源:spectrumnews 网站,https://www.spectrumnews.org/news/angelman-therapy-appears-safer-in-restarted-trial/)
三管其下的“雷特药”——NGN-401和TSHA-102
摘要:
2023年中,Neurogene公司的针对雷特综合症(Rett Syndrome)的NGN-401基因治疗方案,开始进入临床I/II期试验。2023年底,Taysha也推出了类似的雷特综合症TSHA-102基因治疗药物,分别在美国和加拿大等地进行2项临床I/II期试验。
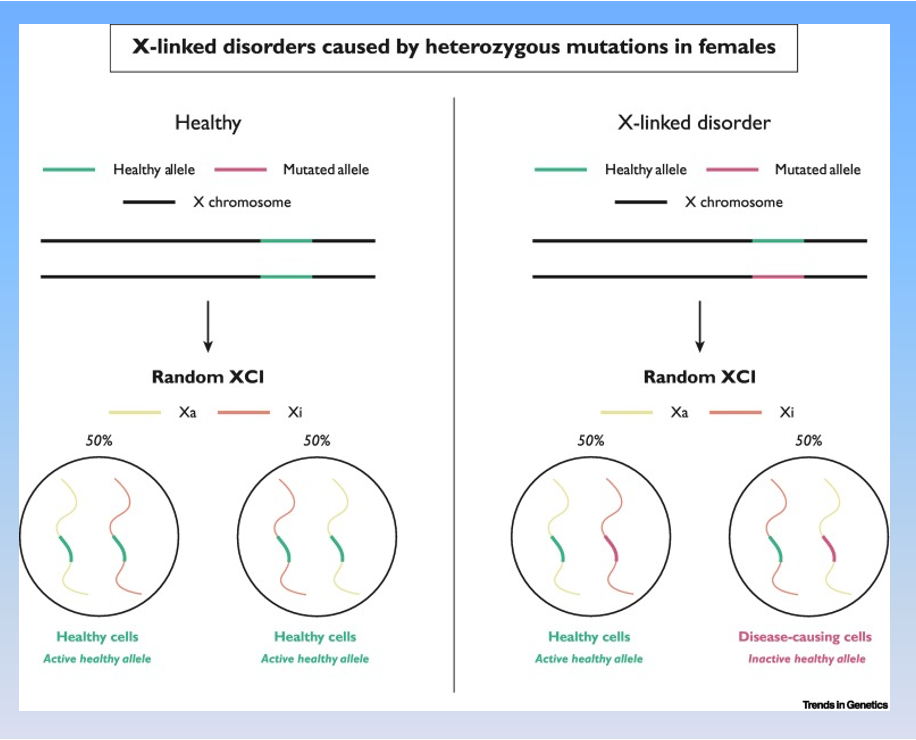
雷特综合症伴X染色体遗传原理。(Trends Genet. 2022 Sep;38(9):920-943.)
雷特综合征的基因机制:
雷特综合征(Rett Syndrome),主要影响女孩子,而且几乎影响了生活的方方面面:她们常伴有语言、步行、进食、睡眠等障碍,严重者伴有呼吸障碍。雷特发病概率大概是1:10000的新生女婴,属于一种罕见的基因疾病。一般在6-18月内因发育未达指标而被家长和医护发现。雷特综合症常有标志性手部重复刻板运动,伴随着一些类似自闭症的症状。大多数雷特综合征人士能存活至成年,但无法生活自理。
雷特综合征人士有时会出现已获得的发育能力逐渐丧失,并呈现进行性智力下降的局势,曾经被认为是一种倒退型自闭症,在美国《精神障碍诊断和统计手册》第4版中(DSM-IV),属于自闭症障碍的范畴。
1999年,美国休斯敦贝勒医学院的Huda Zoghbi的研究小组认为,Rett综合征的基因机制是X染色体上的甲基-CpG-结合蛋白2(MECP2)基因或拷贝数发生突变而造成的。目前已知有900多个不同的MECP2基因突变,常见有8个突变热点。MECP2基因存在于人类的X染色体上。男性只有一条X染色体,无法“承受”MECP2变异带来的严重伤害,往往刚刚出生就夭折(少数生存下来的症状会比较严重),女性有两条X染色体,一个X染色体上MECP2变异,可能被另一条没有变异的X染色体补偿而得以生存。因此,雷特综合征常见于女孩子。因为这个确定的基因基础,DSM-5中,雷特综合征单列出来,不再划归自闭症范畴——这点引起了很多的批评。
https://www.rettsyndrome.org/about-rett-syndrome/what-is-rett-syndrome/)
MECP2蛋白是一种转录调节因子,能够调控基因的表达,具有转录激活子和抑制子的双重作用,在表观层面对中枢神经系统发育和正常功能的维持起重要作用。研究发现,MECP2基因可以激活2184个基因,也可抑制377个基因表达。MECP2基因突变可能会导致产生的蛋白表达量缺失、功能缺陷,或者过度表达蛋白。所以,MECP2是一种控制着数千种基因表达的开关,开关多了少了都不行! 部分实验表明,海马和皮质神经元缺失或过表达MECP2蛋白时,树突分支形成减少,中枢神经系统可塑性受损,造成学习和记忆损伤,表现出智力及语言的障碍。目前,国际和国内的一些团队已经开发了MECP2转基因小鼠及食蟹猴模型,希望能对疾病的发生机制有所贡献。(资料来源:中国科学院神经所,http://www.cebsit.cas.cn/kpwz/201907/t20190703_5332568.html)。2023年,美国FDA批准了首款针对雷特综合征的药物,一种化学多肽的小分子Daybue (trofinetide)。
雷特综合征的基因治疗方案
Neurogene公司的NGN-401是一种通过病毒载体(腺相关病毒,AAV9)携带全长的人MECP2基因,进行蛋白过表达的基因治疗手段。NGN-401设计是通过小脑脑室内一次性给药的办法,将这些工程改造过的病毒输入脑脊液内,通过脑脊液循环,病毒感染了相应的神经细胞,并表达正确的MECP2蛋白,从而执行其功能。
Taysha公司的TSHA-102,与Neurogene公司的NGN-401技术手段是比较相似的,都是通过病毒载体(也是腺相关病毒9,AAV9)作为载体,携带迷你版的人MECP2基因进行治疗。TSHA-102设计是通过一次性脊髓腔内注射给药办法,将这些工程改造过的病毒输入脑脊液内,通过脑脊液循环,病毒上行感染脑内相应的神经细胞,并表达迷你版的MECP2基因片段(每个基因,除了表达蛋白质的那段碱基序列,还有调控等功能的序列。迷你版的基因片段,就是将调控功能的序列删除,只留下表达蛋白的序列), 从而表达该蛋白,从而执行其功能。
NGN-401和TSHA-102可能的一些短板:
1. 病毒载体:这是一个老生常谈也在不断改进的问题。记性好的读者应该还能回忆起我们在前文介绍的基因治疗二十年前失败的案例,很大程度上与当时的病毒载体有关。此次,我们也注意到两家都不约而同得采用了AAV9,可能是因其毒副作用低,并可以穿透血脑屏障的特性。另外,与传统的其他病毒载体相比,AAV总体是不会整合基因组的,但是还是有极少的情况下,人们曾经在实验室见到了这种整合。简而言之,病毒可能会改变被试者的基因组,并且这些改变尚不清楚。(Nat Rev Drug Discov. 2019 May; 18(5): 358–378.)
2. 治疗设计的前提是,通过过量表达MECP2蛋白来弥补被试者体内缺失的蛋白,因此它们针对的都只是先天伴有MECP2蛋白缺陷的雷特综合症人群,对于其他的包括MECP2的过表达或者框移等突变方式无效。但是,正如我们上文提到的,“MECP2是一种基因开关,开关多了少了都不行!”如何控制治疗AAV携带的MECP2的适量表达,不多不少,需要持续监控,而且目前也不太清楚治疗中,能否准确调节控制病毒的表达能力。
3. 还是特异性的问题:两家都选择了通过脊椎穿刺注入病毒,让病毒上行感染脑内细胞的办法。虽然目前实验室里可以通过一些技术手段让病毒特异性感染某些细胞,甚至是大部分的神经细胞,但是脑内的细胞种类众多,且不同脑区包含多种细胞类型(神经元、胶质细胞等),而AAV病毒可能不能感染所有的细胞类型。我们没在公开资料中看到两家厂商是如何控制这个特异性感染的问题,希望只是我们的杞人忧天。
4. 临床操作风险,相比重复给药,这两个药物目前仅需要一次性给足就行。但是无论是小脑脑室内注射,或者脊椎穿刺,都还是存在一定的操作风险。并且病毒毕竟是一种具有生物活性的物质,对于每一批样品的制备、存储和操作上来说,都是需要格外注意的!
临床试验进度:
目前,两家公司都在进行I期临床试验的受试者招募,我们将持续关注其临床进展。与此同时,两家公司都设立了5年以上的观察期,就是为了防范风险。 我们只能慢慢等待其结果了。
“管中窥豹”——JAG-201
摘要:
2024年1月31日,Jaguar公司宣布,针对SHANK3的基因治疗方案,获得美国FDA的批准进行。由于刚刚获批,目前能收集到的公开信息还不太多。Jaguar,是美洲豹之意,大有“管中窥豹”的感觉。但是,和天使综合征与雷特综合征不一样的是,SHANK3作为单基因机制的障碍,还没有被DSM排除在自闭症的范畴,所以自闭症社区一片欢呼,将针对SHANK3的笼统地称为自闭症的基因治疗,有失偏颇,也是一种“管中窥豹”的解读。
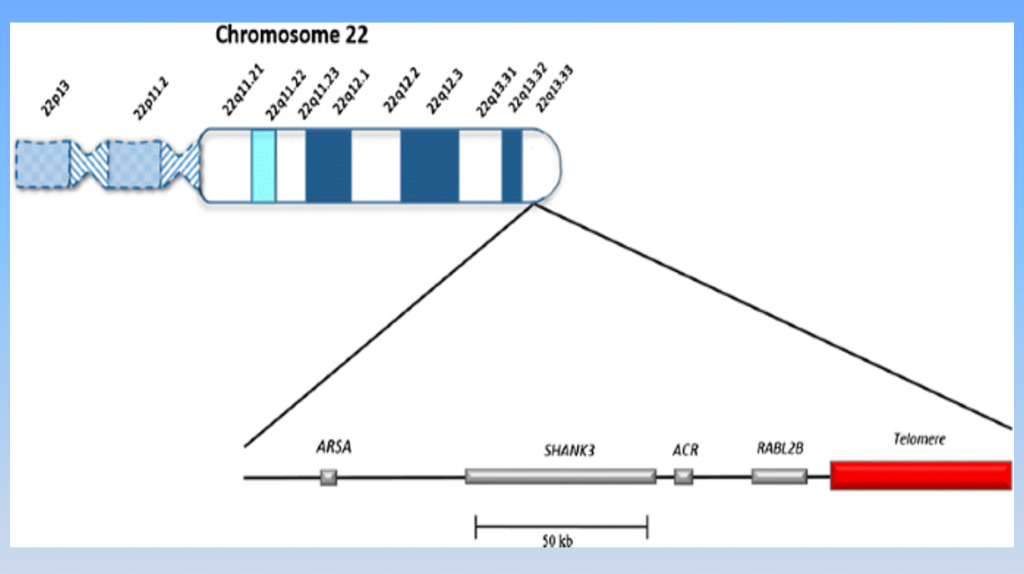
PMS缺失的染色体片段来源:(国际)PMS基金会,https://pmsf.org/about-pms/#cause)
Phelan-McDermid综合征的基因机制:
Phelan-McDermid综合征(Phelan-McDermid syndrome,PMS),也被称为22q13 缺失综合征,是一种罕见的遗传病。顾名思义,主要是由于患者体内的22号染色体长臂末端13区完全或者不完全缺失导致,每名PMS个体因其染色体缺失程度不同,因此临床表现复杂多样,主要包括全面发育落后、智力障碍、肌张力降低、语言发育迟缓、轻度畸形等,但缺乏特异性,容易被误诊。据估计,欧洲国家PMS 的发病率至少为三万 分之一。需要指出的是,PMS个体表现出的刻板行为、沟通交流障碍和自闭症的特质吻合,因而,75%的PMS人士被诊断有自闭症。然而PMS个体还有其他障碍,基因诊断是目前确认PMS的金标准。
回到基因问题,尽管PMS人群的22号染色体长臂缺失各不相同,目前认为其自闭症的特质主要是其中的SHANK3基因变异所致(见图)。SHANK3蛋白是一种神经突触蛋白,在维持神经信号传导中起到重要的作用,对于神经系统发育也有贡献。PMS个体的SHANK3基因缺失也不尽相同,有的是部分缺失,有些是碱基错义,有些是完全缺失,还有一些突变不是缺失而是基因片段部分区域的重复。但总体说起来,PMS症状主要是由于SHANK3蛋白表达量不足(Haploinsufficiency)引起的。目前,国际和国内的科研团队针对此基因已经开发了多种转基因小鼠,甚至转基因猴的模型,并且转基因猴模型基本复现了PMS自闭症类 的行为障碍(来源:(国际)PMS基金会,https://pmsf.org/)。
目前认为SHANK3变异造成的自闭症占自闭症总人数的1-3%。未来DSM进一步修改的时候,不知道会不会像雷特综合征一样,由于有明确的基因机制而不再属于自闭症的范畴。
Phelan-McDermid综合征的基因治疗方案:
据Jaguar公司的网页介绍,该药获得了MIT和哈佛大学的专利授权,有些新闻报道是他们与MIT的美国艺术与科学院院士冯国平教授进行合作,共同研制这个治疗方案。2024年1月31日,Jaguar公司宣布他们的临床试验设计已经通过FDA的批准,但是没有披露详情。由于有之前天使综合征和雷特综合征的基因治疗方案存在,很多人预计Jaguar公司将采用最新的、最时髦的基因编辑技术。
2024年2月22日,Jaguar公司与非盈利组织CureShank和PMS基金会联合召开了一次线上的介绍会。根据该会的介绍和从Jaguar公司网站上获得的信息,与很多人预计的不一样的是,JAG-201的治疗方案,同样也是一种通过病毒载体(腺相关病毒,AAV9)携带SHANK3基因,进行蛋白过表达的基因的治疗手段。他们采用的技术是是通过脑部,在颅骨上开个小洞,直接将SHANK3基因注射到相关的神经元细胞附近,表达的蛋白质直接起到功能作用。
Jaguar公司的负责人Brian Moy和Dan Gallo在分享会上指出,他们公司有在颅骨上开个小洞注射的经验,所以,在临床操作上,并不存在技术困难。同时,将注入的SHANK3基因通过腺病毒载体表达,不会融入人体的DNA,不会改变遗传物质。也正因为不会融人体的DNA,不能自动复制,在细胞分裂时,就可能被稀释而失去作用。但是,神经元细胞和人体其他细胞不一样的是,比较稳定,细胞分裂比较慢,所以他们预计两次注射就基本上够了。真正的稀释可能更多地源于注入的细胞不一定能够准确地送入相关细胞,从而起不到作用。
另外,从基因层面说,尽管SHANK3基因缺失是PMS的主要基因机制。然而,在一些个体身上,他们缺失的是22号染色体长臂的一段,不仅仅只有SHANK3单一基因。是否在补充了SHANK3蛋白后,其他基因缺失引发的症状也能减缓或消失,这是一个尚待回答的问题。
临床试验进展
Jaguar公司的JAG-201的治疗方案刚刚被FDA审批通过,公司还在继续与FDA商谈确定最后的方案。在线会议上,Jaguar公司负责人介绍说,首批受试者的对象是成年人,将制定严格的受试者挑选标准,而且不会很多(甚至可以最少是3个受试者),具体的地点也没有确定。初步的临床试验在2024年下半年开始。
作者:望望同学(神经生物学博士);丫丫爸爸(化学博士)
文案校对:桂林毛豆妈,桂林泡泡妈
版式编辑:上海洋洋妈
