来源:大米和小米 2024-03-22 18:03 广东全世界的自闭症家庭,等到了一个重磅的消息:美国食品药品管理局(FDA)批准通过了SHANK3基因治疗的临床申请。(全球首个!自闭症基因疗法即将启动人体试验——
本来,天使综合征(UBE3A)和雷特综合征(MECP2)的基因治疗早就在临床试验。但是,天使综合征和雷特综合征在DSM-5中,不再属于自闭症的范畴,对自闭症社区来说,似乎比较遥远。
但是,FDA批准进入临床基因治疗的SHANK3还属于自闭症的范畴。于是,不乏人炒作,认为自闭症的基因治疗的春天来了。
基因治疗无疑是现代生物学和医学领域最热门和看起来非常有希望的治疗方案。在饱受社会的不理解、不包容、歧视甚至诅咒的家长群体中,最先进的基因治疗方案进入自闭症领域,春天好像真的来了。
本文转载整理自微信公众号小丫丫自闭症作者 | 望望同学(神经生物学博士)丫丫爸爸(化学博士)
编辑 | 眉沙
自闭症基因治疗的可能性还不高
根据FDA的定义,基因治疗(Gene Therapy)是通过调节或者操纵基因的表达,改变人体活细胞中的生物活性物质,治疗甚至治愈某项疾病。由于某些变异,造成基因功能异常,可能造成基因的产物(生物活性物质比如蛋白质)太少或者太多,从而影响人的生理功能而造成疾病。
一种方法是可以运用分子生物学手段,将基因、基因片段的核酸(DNA或者RNA)直接导入人体内。或者先在体外,通过基因技术改造特定细胞,再重新导入患者体内(比较多的是针对癌症的治疗),从而调节体内生物活性物质水平,达到治疗目的。
另一种方法是直接修改编辑致病的遗传基因,也就是基因编辑,从而达到治疗目的。
过去几年中,针对遗传疾病和癌症的基因治疗表现出惊人的功效,使得社会公众都加入到了对基因治疗的认知热潮之中。 不管用哪种方法,基因治疗的关键,首先要知道目标基因。也就是说,任何疾病或障碍,首先必须有明确的基因机制,必须知道造成疾病或障碍的基因变异是什么,而且最好是只有一个基因变异,这样基因治疗的目标性才能更强。
其次,需要合适的手段,将治疗的基因药物输入体内。很多基因治疗的药物不稳定,不能直接口服送入体内,而像自闭症这样的神经发育障碍,其基因变异往往在中枢神经系统,药物如何通过脑血屏障,也不能简单口服送达。
目标基因的不确定性和基因药物有效地送达指定的人体细胞,是目前自闭症基因治疗中最大的挑战。
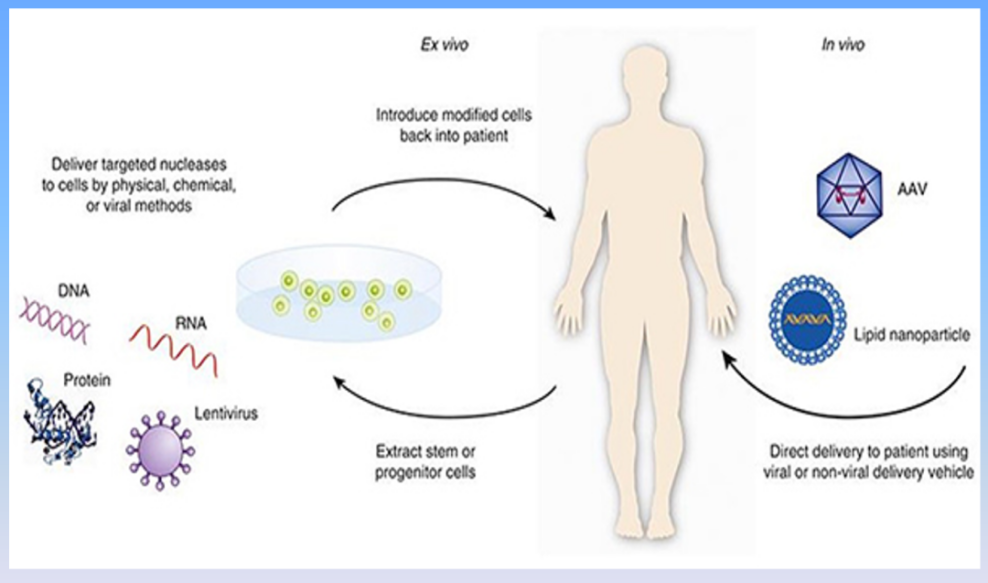
基因治疗原理 图源:FDA官网
从1979年以来,至少有4个大型的双胞胎研究证明自闭症的基因基础,之后几个大型基因数据库的建立,发现了100-1000个数量不等的所谓“自闭症基因”。
但是,问题往往是这样,诊断一个孩子有自闭症,然后可能发现这些所谓“自闭症基因”的变异,而反过来,有这些变异的个体却可能根本不符合自闭症诊断,所以,也有人认为,不应该有所谓的“自闭症基因”这样的说法。
越来越多的研究认为,自闭症是多基因变异叠加的结果,或者像澳大利亚社会学者、自闭症神经多样性概念的提出者,Julie Singer指出的,自闭症,特别是那些程度轻微的个体,他们的自闭症特质甚至可能是种性格。那么这样的自闭症,就是成千上万基因变异共同作用的结果——这也构成了我们每个人的特殊之处,也是自闭症多样性或者异质性的表现。
从异质性这点来说,自闭症历史80年来,没有作用于自闭症核心障碍的药物就容易理解了,而自闭症的基因治疗当然也就无从谈起。
目前真正有进展的是几个所谓的单基因机制的自闭症和相关障碍,包括:天使综合征(UBE3A)、雷特综合征(MECP2)、脆性染色体X综合征(FMR1)、Phelan-McDermid (SHANK3)、SCN2A、CHD8等。
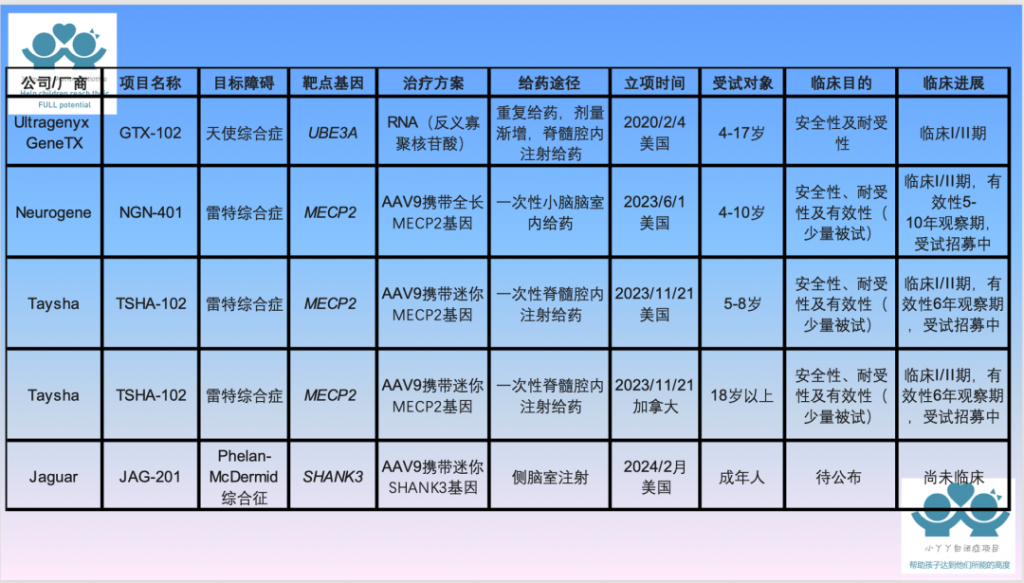
图源:丫丫爸爸
目前,基因治疗仅仅处于研究或者概念形成阶段,而且主要集中在这几个基因上。同时,正因为有单基因机制,天使综合征、雷特综合征和脆性染色体X综合征,在最新的自闭症诊断标准中,已经被单独列出来,不再属于自闭症范畴。 对庞大的自闭症群体来说,这几个明确单基因机制的个体人数相对较少。所以,对大部分自闭症个体来说,尽管自闭症基因治疗概念很热门,也许未来的基因测序还会发现更多的单基因机制,但是在可预见的未来,自闭症的基因治疗可以期待,不能等待。
自闭症基因临床试验现状
任何药物治疗,包括自闭症的基因治疗,首先需要经过临床试验。
目前,世界各国普遍参考和采用FDA制定的临床试验分期标准,一些人会将临床前的动物实验称为临床0期,FDA将涉及人体的临床试验分为1-4期:
I期临床试验:招募20-100健康志愿者或者患者,进行药物或者治疗手段的安全性和剂量耐受性试验,一般持续数月至1年。约有70%的药品试验可能通过至下一阶段。
II期临床试验:招募数百名的患者,进行药物有效性试验,一般持续数月至2年。约有33%的药品试验可能通过至下一阶段。
III期临床试验:招募300名以上至数千名疾病被试,进行扩大样本的药物试验,同时检测可能的副反应。一般持续数年。约有25-30%的药品试验可能通过至下一阶段。
IV期临床(上市后):一般获得理想的III期临床试验结果后,FDA会通过公开讨论(专家意见+家庭、社会代表)对该药放行,允许其上市使用。IV期临床是指在药品上市后的持续市场监测。
据统计,在过去近20年中(2000-2017),仅有9%的心血管药、13%的神经系统药物、5%的抗生素、5%的抗病毒药、12%的抗肿瘤药和15%的其他生物药物通过FDA批准上市。 药物研发是一个长期、高投入的过程,基本上要经历10年左右的研发和审批时间,花费数十亿美金。并且在药品上市前或者上市后,一旦出现严重不良反应,FDA可能会暂停药品的临床试验,要求提供进一步资料,甚至直接停止临床试验。一些有严重不良反应的药物会立即被召回,甚至可能会进入司法程序等。 自闭症的基因治疗大体上也要经历同样的过程。 根据Clinicaltrials的注册信息以及相关厂商官方信息,我们总结了现有五项自闭症(类)临床试验。如果自闭症个体进行了基因测序,正好有相同的基因变异,可以去咨询相关公司的进展情况。
“天使综合征”基因治疗方案——GTX-102
天使综合症(Angelman Syndrome)的GTX-102项目,是最早立项、通过FDA审批,并投入临床试验的基因治疗方案。 然而,因为曾经出现给药后严重的不良反应,被FDA叫停两年时间。Ultragenyx GeneTX修改了原先的方案,降低副作用,FDA再次对其放行,公司又完成了一次临床试验。 目前,Ultragenyx GeneTX正在进行前期临床数据总结,以及筹划新一期更大规模、更多中心的伴随随机组临床试验,预期在2025年底结束本期临床试验。
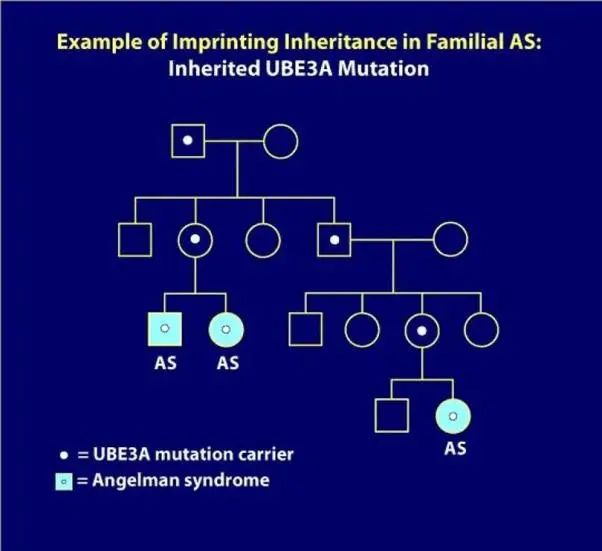
天使综合症遗传致病原理 图源:(国际)天使综合症基金会
三管其下的“雷特药”——NGN-401和TSHA-102
2023年中,Neurogene公司针对雷特综合症(Rett Syndrome)的NGN-401基因治疗方案,开始进入临床I/II期试验。2023年底,Taysha也推出了类似的雷特综合症TSHA-102基因治疗药物,分别在美国和加拿大等地进行2项临床I/II期试验。
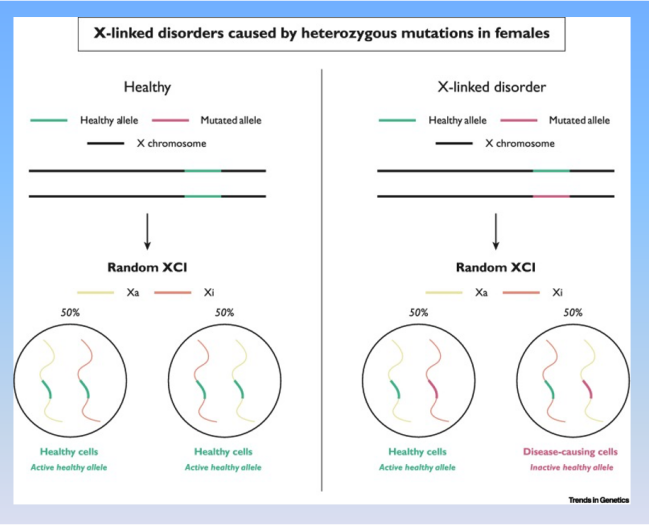
雷特综合症伴X染色体遗传原理(Trends Genet. 2022 Sep;38(9):920-943.)
延伸阅读——关于天使综合征与雷特综合征,详见推文邹小兵:自闭症孩子有这些容貌特征,小心罕见病
“管中窥豹”——JAG-201
2024年1月31日,Jaguar公司宣布,针对SHANK3的基因治疗方案,获得美国FDA批准进行。由于刚刚获批,目前能收集到的公开信息还不太多。 Jaguar是美洲豹之意,大有“管中窥豹”的感觉。但是,和天使综合征与雷特综合征不一样的是,SHANK3作为单基因机制的障碍,还没有被DSM排除在自闭症范畴,所以自闭症社区一片欢呼,将针对SHANK3笼统称为自闭症的基因治疗有失偏颇,也是一种“管中窥豹”的解读。 Jaguar公司的JAG-201治疗方案刚刚被FDA审批通过,公司还在继续与FDA商谈确定最后的方案。在线会议上,Jaguar公司负责人介绍说,首批受试者的对象是成年人,将制定严格的受试者挑选标准,而且不会很多(甚至可以最少是3个受试者),具体地点也没有确定,初步的临床试验在2024年下半年开始。
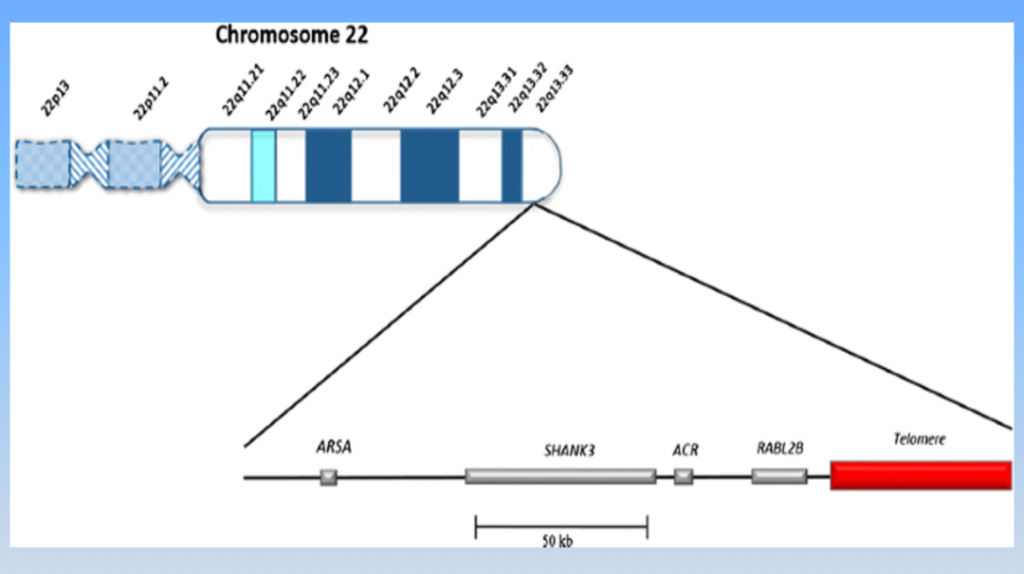
PMS缺失的染色体片段,来源:(国际)PMS基金会
延伸阅读——关于SHANK3的基因治疗,详见推文:全球首个自闭症基因疗法即将启动人体试验
自闭症基因治疗,有多少期待就有多少担心
首先,跳出纯科学的讨论。自闭症是一种异质性是很高的神经发育障碍,而自闭症人士对自身的认知也千差万别,有些可能会认同自闭症治疗,另一些则正好相反,他们为自身的“神经多样性”感到自豪。
因此,是否要治疗某个具体个体,我们需要征询其主观同意,才能实施研究和治疗。
其次,基因编辑技术(CRISPR-CAS)能编辑修复人体本身的基因,是现代基因治疗中最火爆的技术。
然而,在我们盘点自闭症基因治疗技术的过程中,还没有直接使用基因编辑的治疗方案,目前都是将一段替代基因导入人体进行表达,从而恢复因为变异而失去功能的人体本身的基因。
不仅自闭症领域,2024年1月25日,著名的《柳叶刀》杂志发表的,复旦大学附属眼耳鼻喉科医院首次利用基因治疗恢复遗传性耳聋患者听力和言语的重大成果,采用的也是类似方案。Jaguar公司宣布的SHANK3基因治疗也不是直接的基因编辑,而是基因导入。
几年前,深圳有学者利用“CRISPR-Cas9基因编辑技术”,基因编辑了一对胚胎细胞,使其获得先天免疫艾滋病的能力。两个基因编辑后婴儿的诞生,受到了整个科学界的反对和谴责,基因编辑婴儿本身涉及仍未解决的伦理和技术问题,引起了全世界的担忧。
根据我们得到的资料,Jaguar公司声明,他们选择将替代的SHANK3基因导入的原因,是为了保证不改变人体的遗传物质DNA。在为自闭症的基因治疗欢呼雀跃的时候,这应该是一个需要严肃考虑的问题。
最重要的是,正如我们之前提到的,自闭症有基因基础,但目前为止,不足20%的自闭症是明确的单基因遗传基础,绝大多数自闭症的基因基础并不清楚,很多甚至大多数可能是多基因遗传和环境基础共同作用的结果。而基因治疗的基础,目前都是单一遗传基因。
就好比一把钥匙只能开一把锁,而每一把锁都需要花费巨大、历经重重困难、还要等待数年至数十年的时间,才能找到那把唯一的钥匙。
绝大多数自闭症,短期内甚至都找不到锁眼的位置,更不要说找钥匙了。即使找到了那把钥匙,开了那个锁,可能也仅仅是改善某些特质,而不能完全反转自闭症特质。
我们更加的担心是,现代基因技术的先进性,可能会给公众带来虚幻的希望。不排除有人宣称自己开发了全世界最先进的自闭症基因治疗方案,甚至在微信公众号文章发布其有效性数据——这点已经在一些所谓的自闭症治疗方案中有了先例。
事实上,任何治疗方案的开发,都是投入巨大,耗时数年,FDA的审批通过率却只有 5-10%。
当然,我们依然对这些新的临床信息抱有希望,因为我们对未来仍抱有希望。
END
